Кортикостерон, EIA4164
Кортикостерон является глюкокортикоидным гормоном, секретируемым корой надпочечников. Кортикостерон продуцируется в ответ на стимуляцию коры надпочечников адренокортикотропным гормоном (АКТГ) и является предшественником альдостерона. Кортикостерон оказался удобным для использования в качестве главного индикатора стресса, так как стресс увеличивает продукцию кортикостероидов.
Концентрация кортикостерона и степень стресса изучаются в экспериментах по нарушению воспроизведения долговременной памяти (1), уровень кортикостерона хронически повышается при лечебном голодании (2) и в ответ на ожоговое поражение3. Кроме участия в механизме стресса, кортикостерон, по-видимому, играет решающую роль в состояниях сон-бодрствование (4,5).
1. Hupe, J.M., et al, Nature, 1998, 394, 784-787.
2. Kitaysky A.S., et al, J. Comp. Physiol, 2001, 171, 701-709.
3. Thellin O, Noel G, Khuana S, Ogle CK and Horseman N, Shock, 2001, 16 (5), 393-397.
4. Krame, K.M., Sothern R.B., Chronobiol. Int., 2001, 18 (6), 933-945.
5. Vazquez-Palacios G, et al, Pharmacol. Biochem Behavior, 2001, 70 (2-3), 305-310.
[quickshop product="Кортикостерон, EIA4164"]
Кортизол (в сыворотке), EIA1887
[quickshop product="Кортизол (в сыворотке), EIA1887"]
Кортизол (в моче), EIA2989
Кортизол (антиген) образца соревнуется с меченым пероксидазой хрена кортизолом (антигеном с ферментной меткой) за места связывания с ограниченным количеством участков антител к кортизолу на микротитровальных лунках (твердая фаза). После инкубации несвязанный кортизол удаляется в ходе промывки. Затем добавляются субстрат фермента (H2O2) и хромоген (TMБ). По истечении необходимого для проявления окрашивания времени ферментативная реакция останавливается и определяется оптическая плотность. Концентрация кортизола в образце рассчитывается по стандартам. Интенсивность окрашивания обратно пропорциональна концентрации кортизола в образце.
1. Foster, L. B. and Dunn, R. T. Clin. Chem. 20/3 365 (1974)
2. De Lacerda, et al J. Clin. Endocr. and Metab. 36,227 (1973)
3. Rolleri, E., et al Clin. Chim. Acta 66 319 (1976)
4. Kobayashi, Y., et al Steroids, 32 no 1 (1978)
5. Akarawa, et al Anal. Biochem. 97 248 (1979)
[quickshop product="Кортизол (в моче), EIA2989"]
Глобулин, связывающий половые гормоны (SHBG), EIA2996
Гормон, связывающий половые гормоны (ГСПГ) – это ß-глобулин, который специфически связывает стероидные гормоны. Его молекулярный вес 86 кДа/моль. Вырабатывается в основном гепатоцитами. Его выделение кроме прочих зависит от соотношения андрогена и эстрогена, тиреоидных гормонов, инсулина и диетических факторов. ГСПГ участвует в транспортировке половых гормонов в плазме. Его концентрация – главный фактор, определяющий состояние между связанной с протеином и свободной формой. Определение ГСПГ важно при легких формах метаболизма андрогенов; оно позволяет определить гирсутизм у женщин, которым можно было бы использовать эстрогеновую терапию. Показатель Тестостерон/ГСПГ хорошо кореллирует с измеренными и подсчитанными значениями свободного тестостерона и помогает различить людей с чрезмерной андрогенной активностью и здоровых людей.
1. Moore, J. W. and Bulbrook R. D. (1988). The epidemiology and function of sex hormone binding globulin. IN Oxford Rewievs of Reproductive Biology, 10: 180 — 236.
2. Selby, C. (1990). Sex hormone binding globulin: origin, function and clinical significance. Ann. Clin. Biochem. 27: 532 — 541.
[quickshop product="Глобулин, связывающий половые гормоны (SHBG), EIA2996"]
ДГЭА, EIA3415
Дегидроэпиандростерон (DHEA, ДГЭА, 3-гидрокси-5-андростен-17-один) является C19 стероидом, секретируемым корой надпочечников и, в меньшей степени половыми железами. ДГЭА — предшественник биосинтеза тестостерона и эстрогенов. ДГЭА быстрее выводится с мочой, чем ДГЭА-С. Из-за этого, уровень ДГЭА в сыворотке в 100-1000 раз ниже, чем уровень ДГЭА-С. Уровень ДГЭА в сыворотке относительно высок у плода и новорожденных, низок у детей, и вновь увеличивается во время полового созревания. После тридцати лет уровень ДГЭА постепенно снижается. Концентрация ДГЭА в сыворотке увеличивается в зависимости от кортикотропина и АКТГ. В течение менструального цикла или беременности изменений уровня ДГЭА в сыворотке не происходит.
1. Mo Q, Lu SF, Simon NG. Dehydroepiandrosterone and its metabolites: differential effects on androgen receptor trafficking and transcriptional activity.
J. Steroid Biochem. Mol. Biol. 2006; 99 (1): 50–8.
2. Webb SJ, Geoghegan TE, Prough RA et al. The biological actions of dehydroepiandrosterone involves multiple receptors. Drug Metabolism Reviews 2006; 38 (1–2): 89–116.
3. Chen F, Knecht K, Birzin E, et al. Direct agonist/antagonist functions of dehydroepiandrosterone. Endocrinology 2005; 146 (11): 4568–76.
4. Kamrath C, Hartmann MF, Wudy SA.Androgen synthesis in patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Horm. Metab. Res. 2013; 45 (2):86-91.
5. Savineau JP, Marthan R, Dumas de la Roque E. Role of DHEA in cardiovascular diseases. Biochem. Pharmacol. 2013; 15; 85 (6):718-26.
6. Traish AM, Kang HP, Saad F, Guay AT. Dehydroepiandrosterone (DHEA) — a precursor steroid or an active hormone in human physiology. J Sex Med. 2011; 8 (11):2960-82.
7. Rachoń D. Differential diagnosis of hyperandrogenism in women with polycystic ovary syndrome. Exp Clin Endocrinol. Diabetes. 2012; 120 (4):205-9.
8. Sciarra F, Tosti-Croce C, Toscano V. Androgen-secreting adrenal tumors. Minerva Endocrinol. 1995; 20 (1):63-8.
9. Miller WL. Androgen biosynthesis from cholesterol to DHEA. Mol Cell Endocrinol. 2002; 30; 198 (1-2):7-14.
[quickshop product="ДГЭА, EIA3415"]
ДГЭА-Сульфат, EIA1562
Дигидроэпиандростерон это стероидный гормон присутствующий в крови преимущественно в форме сульфата. ДГЭА-С это более специфичный продукт надпочечников и измерение этого стероида широко применяются в клинической практике. Клиническое значение анализа ДГЭА-С в плазме связано с диагностикой гиперплазии надпочечников и дифференциальной диагностикой гирсутизма
1. Tietz, N. W., Textbook of Clinical Chemistry, Saunders, 1968
[quickshop product="ДГЭА-Сульфат, EIA1562"]
Андростендион, EIA3265
Стероидный гормон андростендион один из важнейший андрогенов кроме тестостерона и дигидротестостерона. Тестостерон, наиболее важный биологически активный андроген, образуется в результате периферического ферментативного изменения андростедиона.
У мужчин андрогены секретируются преимущественно клетками Лейдига и в некоторой степени корой надпочечников. У женщин андрогены секретируются надпочечниками и яичниками.
Примерно 10% андрогенов образуются в результате периферической конверсии, преимущественно из ДГЭА. Андростендион и тестостерон показывают высокую суточную изменчивость. Самые высокие уровни утром. В пубертатный период возрастает уровень андростендиона в сыворотке, после менопаузы он опять снижается. Высокие уровни андростендиона наблюдаются во время беременности.
У женщин высокий уровень андростендиона (47-100% выше нормы) выявляется при гирсутизме, чаще всего в комбинации с другими андрогенами, такими как тестостерон и ДГЭА-С. Повышенная выработка андростендиона может быть следствием дисфункции яичников или нарушений работы надпочечников. Высокий уровень циркулирующего андростендиона выявляется у женщин с поликистозными яичниками и недостаточностью 21-гидроксолазы. Значительное снижение уровня андростендиона наблюдается при постменопаузальном остеопорозе.
1. Kicman, A. T., Bassindale, T., Cowan, D. A., Dale, S., Hutt, A. J., and Leeds, A. R. Effect of androstenedione ingestion on plasma testosterone in young women; a dietary supplement with potential health risks. Clin Chem 2003, 49:167-169.
2. Brown, G.A., Vukovich, M.D., Martini, E.R., Kohut, M.L., Franke, W.D., Jackson, D.A., and King, D.S. Endocrine responses to chronic androstenedione intake in 30- to 56-year-old men. J Clin Endocrinol Metab 2000, 85:4074—4080.
3. Erickson GF 1993 Normal regulation of ovarian androgen production. Seminars in Reproductive Endocrinology 11:307-312
4. Mango D, Scirpa P, Battaglia F, Tartaglia E, Manna P. Diagnostic significance of steroid hormones in patients with ovarian cancer. J Endocrinol Invest. 1986 Aug;9 (4):307-14
[quickshop product="Андростендион, EIA3265"]
Адренокортикотропный гормон (ACTH), EIA3647
АКТГ (адренокортикотропный гормон), или кортикотропин, является пептидным гормоном, состоящим из 39 аминокислот (ММ=4500), секретируется гипофизом, чтобы регулировать выработку стероидных гормонов коры надпочечников. Секреция АКТГ из передней доли гипофиза управляется классически механизмом отрицательной обратной связи и опосредованной стрессом ЦНС системой контроля.1 Различные типы стрессов или боли, воспринятые в высших уровнях мозга, модулируют секрецию гипоталамического нейросекреторного гормона, кортикотропин-релизинг-гормона (КРГ), пептида с 41 аминокислотой. КРГ стимулирует гипофизарную секрецию АКТГ. Второй пептид, который модулирует секрецию АКТГ — это вазопрессином (АДГ). Секреция АДГ также стимулируется стрессом и действует синергистически с КРГ, чтобы увеличить секрецию АКТГ в гипофизарном портальном обращении. АКТГ увеличивает синтез и секрецию всех стероидов надпочечника, альдостерона, кортизола и надпочечных андрогенов. Это основной модулятор кортизола, самого важного глюкокортикоида у человека. С увеличением уровня кортизола в крови, секреция АКТГ ингибируется непосредственно на гипофизарном уровне. Через этот же самый механизм уменьшающиеся уровни кортизола приводят к поднятым уровням АКТГ.2,3,4,5 Биологически активный АКТГ получается из ферментативного раскола большой молекулы предшественника, проопиомеланокортина (ПОМК). Эта молекула содержит в своей структуре последовательности аминокислот АКТГ, про-АКТГ, ß-меланоцит-стимулирующий гормон, липотропин, а так же эндорфин и энкефалины. Поскольку реакция в иммунологических исследованиях определена антигенной структурой, а не биологической функцией, обычный АКТГ РИА реагирует с ПОМК, про-АКТГ, АКТГ и некоторыми фрагментами АКТГ.5 Как и другие гипофизарные гормоны, АКТГ секретируется в пульсирующей манере. Эти небольшие импульсы накладываются на характерное суточное колебание большей амплитуды. У здоровых людей АКТГ достигает пика рано утром (6:00 — 8:00 часов). Затем уровни снижаются до конца дня, и самыми низкими они становятся ближе ко сну. Из-за такого суточного ритма общепринято отбирать образцы плазмы на АКТГ между 8:00 и 10:00 часами. Однако, дифференциация пациентов с болезнью Иценко-Кушинга от нормальных людей может быть достигнута наилучшим образом, если образцы отобрать вечером (16:00 — 18:00 часов). При болезни Иценко-Кушинга, а также при синдроме эктопического АКТГ, палитра суточной секреции АКТГ вообще отсутствует. Стресс может также подавить суточное изменение.
Тесты на АКТГ в плазме нужны при дифференциальной диагностике гипофизарной болезни Иценко-Кушинга, болезни Аддисона, автономного производящих АКТГ гипофизарных опухолей (например, синдром Нельсона), гипопитуитаризма с дефицитом АКТГ и синдромом эктопического АКТГ.5,6,7,8,9,10 Синдром Иценко-Кушинга вызван эффектами лишних глюкокортикоидных влияний. Все причины синдрома Иценко-Кушинга, за исключением глюкокортикоидного лечения, связаны с повышенным кортизолом в суточной моче. Самая частая причина синдрома Иценко-Кушинга – двусторонняя гиперплазия надпочечника вследствие гипофизарной гиперсекреции АКТГ (болезнь Иценко-Кушинга), вызванной гипофизарной аденомой или кортикотрофной гиперплазией.5,6,7,8,9,10 Лабораторный диагноз болезни Иценко-Кушинга поддержан следующим: (1) подавление плазменного АКТГ и концентраций кортизола большей дозой (2.0 мг / 6 ч x 8) принимаемого дексаметазона, (2) отсутствие АКТГ и подавления кортизола с низкой дозой (0.5 мг / 6 ч x 8 или 1 мг, данный в 23:30 час) дексаметазона, (3) большее, чем нормальный ответ на метирапона (Метопирон), стимуляция и нормальные или поднятые плазменные уровни АКТГ.4 Когда синдром Иценко-Кушинга вызван первичной надпочечной патологией (аденома или карцинома), действия надпочечника независимы от АКТГ и подавлена гипофизарная секреция АКТГ.5,6,7,8,9,10 Следовательно, нет никакого ответа на подавление дексаметазоном или стимуляцию метапироном. Этот тип синдрома Иценко-Кушинга характеризован очень низкими, или необнаруживаемыми уровнями АКТГ. Поэтому, измерение плазменного АКТГ полезно при дифференциальной диагностике гипофизарного синдрома Иценко-Кушинга. У пациентов с надпочечными опухолями уровни АКТГ низки. Высокие уровни АКТГ замечены у пациентов с синдромом эктопического АКТГ. У пациентов с двусторонней гиперплазией надпочечников будут неадкватно подняты уровни АКТГ для их степени Гиперкортизолизма, который должен подавить АКТГ. Однако, в большинстве случаев концентрация АКТГ будет в пределах нормального диапазона. Недостаточность надпочечников или неадекватная секреция кортизола могут быть вызваны разрушением надпочечной коры или к отклонениям в гипофизе или гипоталамусе, которые приводят к неадекватной секреции АКТГ.5,6,7,8,9,10 Первичных недостаточность надпочечников, Болезнь Аддисона, характеризована заметно поднятыми плазменными уровнями АКТГ и отсутствием чувствительности надпочечников к стимуляции внешним АКТГ. Гипопитуитаризм с дефицитом АКТГ, который является вторичной адренокортикальной недостаточностью, характеризован низкими плазменными концентрациями АКТГ и кортизола, и неполноценным, но обычно отчетливым надпочечным ответом на возбуждение с синтетическим АКТГ (Cortrosyn®). Если для диагноза требуются гипогликемический стресс или стимуляция метиропоном, ответы АКТГ и кортизола менее чем нормальны. Агрессивная и инвазивная секреция АКТГ при гипофизарных опухолях, происходящая до или после двустороннего удаления надпочечников при болезни Иценко-Кушинга (синдром Нельсона), характеризована развитием Аддисоновой пигментации, часто встречающейся у пациентов после адреналектомии, которые находятся на заместительной глюкокортикоидной терапии. У этих пациентов плазменные уровни АКТГ заметно подняты и не дают значительного ответа на подавление дексаметазоном.
1. Ryan, WG: Endocrine Disorders – A Pathophysiiologic Approach, 2nd Edition Year Book Medical Publishers, Inc. 1980.
2. Watts, N.B., J.H. Keffer: Practical Endocrine Diagnosis, Third Edition, Lea and Febioer, 1982.
3. Ganong, WF. L.D. Alber, TC Lee: ACTH and the Regulation of Adrenocorticol Secretion,N. Engl. J. Med. 290 : 1006, 1974.
4. Tepperman, J: Metabolic and Endocrine Physiology, 4th Edition, Year Book Medical Publishers, Inc.,1981.
5. Odell, W.D., R. Horton, M.R. Pandian, J. Wong: The Use of ACTH and Cortisol Assays in the Diagnosis of Endocrine Disorders. Nichols Institute Publication, 1989.
6. Radioimmunoassay Manual, Edited by A.L. Nichols and J.C. Nelson, 4th Edition Nichols Institute,1977.
7. Gold, E.M.: The Cushing’s Syndromes: Changing Views of Diagnosis and Treatment. Ann Intern. Med. 90:829, 1979.
8. Plasma Cortisol, RIA for Physicians, Edited by J.C. Travis, 1:8, Scientific Newsletter, Inc. 1976.
9. Krieger, D.T.: Physiopathology of Cusihing’s Disease, Endocrine Review 4:22-43, 1983.
10. Krieger, D.T., A.S. Liotta, T. Suda, A Goodgold, and E. Condon: Human Plasma Immunoreactive Lipotropin and Adrenocorticotropin in Normal Subjects and in Patients with Pituitary-Adrenal Disease,J. Clin. Endocrinol Metab. 48:566-571, 1979.
[quickshop product="Адренокортикотропный гормон (ACTH), EIA3647"]
17-ОН-прогестерон, EIA1292
Только для диагностического использования in vitro. ДРГ 17-α-OH-Прогестерон ИФА EIA-1292– иммуноферментный набор для количественного определения 17-α-OH-прогестерона в сыворотке человека.
1.2 Общее описание
Стероидный гормон 17-α-ОН-прогестерон (17-α-ОНР) синтезируется в коре надпочечников и в половых железах. 17-α-ОНР обладает очень слабыми гестагенными эффектами. Тем не менее, этот гормон имеет важное клиническое значение, так как он является основным предшественником 11-дезоксикортизола (вещества CpS). CpS образуется в результате гидроксилирования 21-го углеродного атома (С 21). Таким образом, анализируя уровень 17-α-ОНР в крови, можно следить за каталитической активностью 21-гидроксилазы в коре надпочечников.Дефицит 21-гидроксилазы, наиболее часто обнаруживающийся при врожденной надпочечниковой гиперплазии (САН), приводит к избыточной секреции 17-α-ОНР и, как следствие этого, повышению уровня гормона в крови. Дефицит 11-гидроксилазы, однако, приводит к умеренному увеличению уровня 17-α-ОНР. Таким образом, анализ этого стероидного гормона играет важную роль в диагностике врожденной надпочечниковой гиперплазии у новорожденных.
1.3 Клиническая Физиология
Взрослые небеременные женщины:
У взрослых небеременных женщин уровень 17-α-ОНР в крови зависит от фазы менструального цикла. Подобно прогестерону, 17-α-ОНР секретируется зрелыми фолликулами и желтым телом яичника. После овуляции концентрации гормона обычно повышаются.
Кроме того, уровень 17-α-ОНР зависит от дневного ритма и коррелирует с секрецией кортизола надпочечниками. Максимальный уровень гормона обнаруживается в образцах крови, взятых в период от полуночи до 8 часов утра.
Взрослые мужчины:
Существуют указания на то, что у взрослых мужчин наблюдаются сходные изменения в уровне 17-α-ОНР.
Беременные женщины и новорожденные:
Во время беременности большие количества 17-α-ОНР продуцируются плодом, плацентой и надпочечниками. Гормон секретируется в кровь плода и матери. Уровень 17-α-ОНР у матери сильно повышается после 32 недель беременности, в 4 раза превышая уровень гормона в лютеиновой фазе менструального цикла. 17-α-ОНР также может быть обнаружен в пуповине новорожденных.
[quickshop product="17-ОН-прогестерон, EIA1292"]
Плазмин α-2-Антиплазмин Комплекс (PAP Complex), EIA3763
Набор Плазмин альфа-2-Антиплазмин Комплекс (DRG РАР micro ELISA) – иммуноферментный анализ для количественного определения плазмин альфа-2-Антиплазмин Комплекса (PAP) в плазме человека.
Данный набор предназначен только для in vitro диагностики.
Удаление полимеризованного фибрина из сосудистой системы, протеолитическое растворение (фибринолиз) имеет важное значение для поддержания гемостатического равновесия. Ключевым ферментом фибринолитической системы является плазмин. Кроме его фибринолитической функции в плазме, плазмин также играет центральную роль в активации дегенеративных (например, коллагеназы) и воспалительных (например, система комплемента) процессов в тканях.
[quickshop product="Плазмин α-2-Антиплазмин Комплекс (PAP Complex), EIA3763"]
Ферритин, EIA1872
[quickshop product="Ферритин, EIA1872"]
Эритропоэтин, EIA3646
Эритропоэтин (ЭПО) – сильно гликозилированный белок с молекулярной массой 30 000 – 34 000 Да. Человеческий ЭПО – это полипептид, состоящий из 165 аминокислот, содержащих одну О-гликозидную цепь и три N-гликозидных цепи углеводов. Рекомбинантный ЭПО – хорошая замена нативному белку для использования в ИФА. Сывороточный уровень ЭПО зависит от степени выработки и степени выведения протеина. 90% ЭПО вырабатывается перитубулярными клетками взрослой почки в ответ на снижение оксигенации тканей. Есть факты, доказывающие, что протеин в этих клетках, который определяет насыщенность крови кислородом, это гем-содержащий компонент. Со снижением pO2 плазмы, как функции гематокрита, концентрация ЭПО повышается. Также есть наблюдения, позволяющие предполагать, что обычно есть обратная корреляция между уровнем ЭПО в сыворотке и эритроцитарной массой.
Подсчет количества эритропоэтина в сыворотке служить диагностическим признаком в определении причин анемии или эритроцитоза. Апластическая анемия, гемолитическая анемия, а также железодефицитная анемия все ведут к повышению уровня ЭПО. В то же время уровень ЭПО у пациентов с вторичной анемией из-за почечной недостаточности и других заболеваний, таких как синдром приобретенного иммунодефицита (СПИД), обычно необъяснимо низкий для уровня анемии. Это скорее всего вызвано нарушением функции больной почки вырабатывать необходимое кол-во эритропоэтина. Низкие концентрации ЭПО могут предсказать угрозу отторжения пересаженной почки. ЭПО может также использоваться для мониторинга больных СПИДом, принимающих Зидовудин (АЗТ). Повышенная концентрация ЭПО подтверждает, что анемия, связанная с применением АЗТ вызвана гипоплазией эритроцитов или аплазией.
Полицитемия красная (истинная), или первичный эритроцитоз (увеличение эритроцитарной массы), вызывается непростимулированной гиперпродукцией эритроцитов. Отсюда увеличение гемоглобина, вызывающее, как следствие, снижение продукции ЭПО, которое, в свою очередь, вызывает снижение уровня сывороточного ЭПО. Вторичные полицитемии, которые также характеризуются снижением общей эритроцитарной массы, появляются как физиологический ответ на повышенный уровень циркулирующего ЭПО, вызванный тканевой гипоксией. Гипоксия может быть вызвана такими факторами, как фиброз легкого, сердечно-сосудистые заболевания, длительное нахождение на больших высотах, ненормальные формы гемоглобина или лекарственное лечение. Некоторые опухоли вырабатывают ЭПО, и, в этом случае, ЭПО может использоваться как онкомаркер для мониторинга эффективности лечения.
1. Sawyer, S.T., Krantz, S.B., Sawada, K. Receptors for Erythropoietin in Mouse and Human Erythroid Cells and Placenta. Blood 1989; 74: 103-109.
2. Imai, N., Kawamura, A., Higuchi, M., et al. Physicochemical and Biological Comparison of Recombinant Human Erythropoietin with Human Urinary Erythropoietin. J Biochem 1990; 107: 352-359.
3. Jacobson, L.O., Goldwasser, E., Fried, W., Pizak, L.F. The Role of the Kidney in Erythropoiesis. Nature 1957; 179: 633-634.
4. Koury, S.T., Bondurant, M.C., Koury, M.J. Localization of Erythropoietin Synthesizing Cells in Murine Kidney by in-situ Hybridization. Blood 1988; 71: 524-527.
5. Goldberg, M.A., Dunning, S.P., Bunn, H.F. Regulation of the Erythropoietin Gene: Evidence that the Oxygen Sensor is a Heme Protein. Science 1988; 242: 1412—1415.
6. Erslev, A.J., Caro, J., Birgegard, G., Silver, R., Miller, O. The Biogenesis of Erythropoietin. Experimental Hematology 1980; Suppl 8: 1-13.
7. Spivak, J.L. The Mechanism of Action of Erythropoietin. Int J Cell Cloning 1986; 4: 139-166.
8. Erslev, A.J. Erythropoietin. New Eng J Med 1991; 324:1339—1344.
9. Garcia, J.F., Ebbbe, S.N., Hollander, L., Cutting, H.O., Miller, M.E., Cronkits, E.P. Radioimmunoassay of Erythropoietin: Circulating Levels in Normal and Polycythemic Human Beings. J Lab Clin Med 1982; 99: 624-635.
10. Wild, D., editor. The Immunoassay Handbook, Stockton Press, 1994, p. 428.
11. Wide L., Bengtsson C., Birgegard G. Circadian Rhythm of Erythropoietin in Human Serum. Br J Haematol 1989; 72: 85-90.
12. Cahan C., Decker M.J., Arnold J.L., Washington L.H., Veldhuis J.D., Goldwasser E., Strohl K.P. Diurnal Variations in Serum Erythropoietin Levels in Healthy Subjects and Sleep Apnea Patients. J Appl Physiol 1992; 72: 2112-7.
13. Goldwasser E. and Sherwood J.B. Annotation, Radioimmunoassay of Erythropoietin. Br J Haematol 1981; 48: 359-63.
14. Kricka L.J. Human Anti-Animal Antibody Interferences in Immunological Assays. Clin Chem 1999; 45: 942-956.
15. Cotes P.M. and Spivak J.L. Erythropoietin in Health and Disease. Erythropoietin Molecular, Cellular and Clinical Biology, Editors: Erslev A.J., Adamson J.W., Wschbach J.W., Winearls C.G. 1991; Chapter 11:184-207.
16. Jelkmann W. Renal Erythropoietin: Properties and Production. Rev Physiol Biochem Pharmacol 1986; 104: 139-215.
17. Cotes M.P. Anomalies in Circulating Erythropoietin Levels. Annals of NY Acad, Sci 1994; 718:103-9.
18. Wintrobe’s Clinical Hematology, ninth edition, edited by Lee G.R., Bithell T.C., Foerster J., Athens J.W., Lukens J.N. Lea & Febiger, Philadelphia 1993.
19. Fairbanks V. Q & A. CAP Today Nov 1996, pg. 88.
20. Spivak, JL. “Erythrocytosis”, Hematology: Basic Principles and Practice; editors: Hoffman R, Benz EJ Jr., Shattil, SJ; Furie B., Cohen HJ; Silberstein LE; 1995; Chapter 37:484-491
21. Miller, ME, Chandra M, Garcia JF: “Clinical applications of measurement of serum immunreactive levels of erythropoietin”, Ann. N.Y.Acad. Sci. 459: 375-381, 1985.
[quickshop product="Эритропоэтин, EIA3646"]
Гепсидин-25, EIA5258
Золотой стандарт в измерении гепсидина
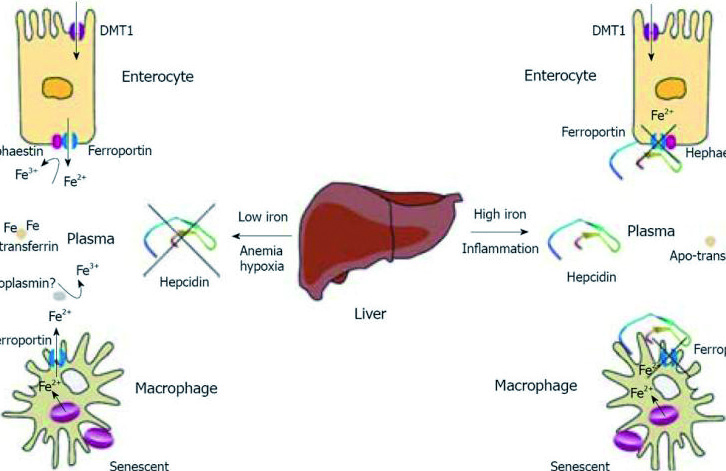
Гепсидин — богатый цистеином пептидный гормон, который состоит из 25 аминокислотных остатков. Продуцируется гепсидин в гепатоцитах и играет важную роль в гомеостазе железа. Показано, что гепсидин контролирует уровень железа в плазме за счет регуляции абсорбции железа из кишечника и высвобождения в макрофагах и гепатоцитах. Гепсидин секретируется в ответ на повышение уровня железа и воспаление. При истощении запасов железа выработка гепсидина уменьшается. Увеличение концентрации гепсидина ведет к снижению абсорбции железа. Снижение уровня гепсидина приведет к увеличению высвобождения железа из энтероцитов и макрофагов.
Принцип анализа
Набор ДРГ Гепсидин-25 (биоактивный) ИФА основан на твердофазном иммуноферментном анализе (ИФА) по принципу конкурентного связывания. На микротитровальных лунках иммобилизованы поликлональные антитела против антигенного сайта молекулы гепсидина. Эндогенный гепсидин из образца пациента конкурирует с конъюгатом биотинилированного гепсидина за связывание с иммобилизованными антителами. После инкубации несвязанный конъюгат удаляется с помощью промывки. Связанный биотинилированный гепсидин детектируют по комплексу стрептавидин-пероксидаза хрена. После добавление раствора субстрата интенсивность окрашивания обратно пропорциональна концентрации гепсидина в образце пациента.
Характеристики анализа
- Принцип анализа: конкурентное связывание, ИФА.
- Легкая и прямая процедура анализа (без экстракции и центрифугирования).
- Все реагенты готовы к использованию.
- Динамический диапазон: 0.354 — 80 нг/мл гепсидина.
- Общее время анализа: около 2 часов (60/30/20мин).
- Объем образца: 20 мкл сыворотки или плазмы (ЭДТА, цитрат, гепарин).
- Два контроля вложены в набор.
- Высокая чувствительность.
Назначение
Данный набор предназначен только для in vitro диагностики и профессионального использования.
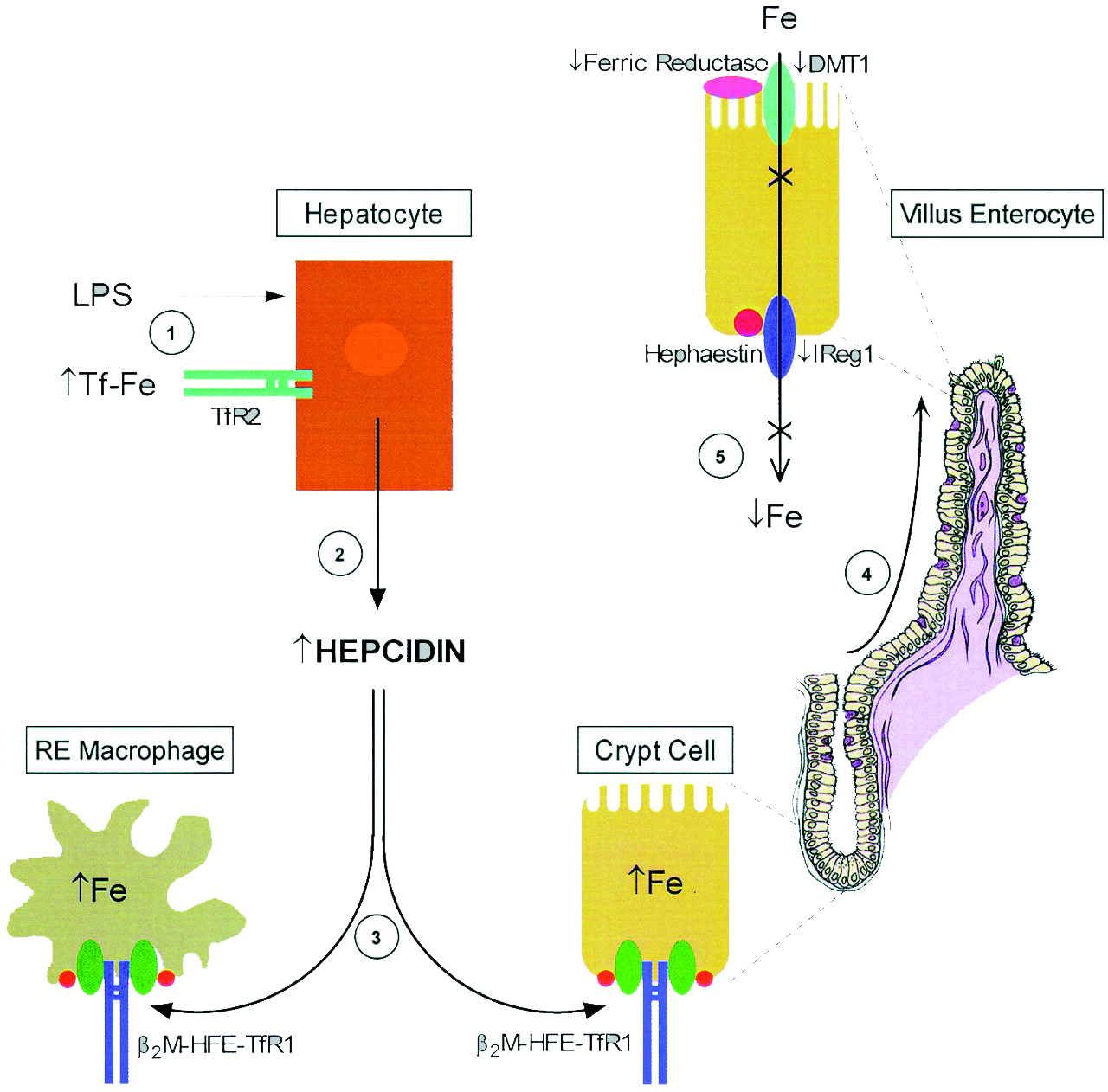
Гепсидин-25 является основным регулятором всасывание железа из пищи и клеточного выброса железа. Он осуществляет свою регуляторную функцию, противодействуя функции ферропортина, основного экспортера железа в мембране макрофагов, гепатоцитов и базолатеральный поверхности энтероцитов. Гепсидин-25 индуцирует интернализацию и деградацию ферропортина, что приводит в результате к увеличению внутриклеточных запасов железа, снижению всасывания железа и концентрации циркулирующего железа.
Некоторые физиологические и патологические процессы регулируют синтез гепсидина. Ситуации, в которых увеличивается потребность в циркулирующем железе (частично эритропоэтическая активность), вызывают снижение гепатоцеллюлярного синтеза гепсидина. Эти условия включают: дефицит железа, гипоксию, анемию и состояния, характеризующиеся повышенной активностью эритропоэза. Снижение уровня гепсидина ведет к высвобождению накопленного железа и увеличению поглощения железа из пищи. С другой стороны, инфекции и воспаление вызывают увеличение синтеза гепсидина, что в свою очередь приводит к дефициту железа, доступного для эритропоэза и считается, что также приводит к запуску механизма, лежащего в основе ретикулоэндотелиальной секвестрации железа, недостаточности кишечного всасывания железа и низкой концентрации железа в сыворотке крови, характерной для анемии хронических заболеваний.
С момента открытия гепсидина, многочисленные исследования способствовали пониманию регуляции гепсидина и его функциональные характеристики. Потенциальные расстройства, связанные с гепсидином, описываюся ниже.
Дисфункция в цепи гепсидин-ферропортин – главный механизм недостаточного количества железа при таких заболеваниях как наследственный гемохроматоз, талассемия и некоторые заболевания печени. И наоборот, переизбыток гепсидина, как следствие воспаления, приводит к эритропоэзу с ограниченным содержанием железа, проявляющемся как анемия хронического воспаления.
Уровень гепсидина легко определить с помощью набора ДРГ EIA-5258 гепсидин-25 (биоактивный).
Литература
- Joyce J.C. Кroot, Harold Т. Jalsma., Robert Е. Flemlng, and Dorine W. Swinkels, Hepcidin in Human lron Disorders:Diagnostic lmplications, Clinical Chemistry 57:12 1650—1669 (2011)
- Esther Zipperer, Jochen G. Post, Matthias Herkert, Andrea Kundgen, Frank Fox, Rainer Haas, NorЬert Gattermann, Ulrich Germlng. Serum hepcldln measured with an improved ELISA correlates with parameten of iron metabolism in patients with myelodysplastic syndrome,Ann Hematol DOI 10.1007/s00277-013-1839-5
- Рагk С. Н., Valore E. V., Waring A. J., Ganz Т. Hepcidin, а urinary antimlcrbial peptide syntheslzed ln the llver. J Biol Chem. 2001; 276: 7806-10.
- Valore E.V., Ganz Т. Posttranslational processing of hepcldin ln human hepatocytes ls medlated bу the prohormone convertase furin. Blood Cells Mol Dis. 2008; 306: 132-8.
- Nemeth Е, Tuttle М.S., Powelson J., Vaughn М.В., Donovan А., Ward D.M., et al. Hepcidin regulates cellular iron efflux bу binding to ferroportin and inducing its intemallzation. Scienc. 2004; 306:2090-3.
- Hentze M.W., Muckenthaler M.U., Galy В. Camaschella С.Two to tango:regulation of Mammalian iron metabolism. Cell 2010. 142: 24 -38.
[quickshop product="Гепсидин-25, EIA5258"]
Презентации
CARDIOLIPIN IgA — набор реагентов для определения IgA-антител к кардиолипину, 2Z51051A
Альдостерон, EIA5298
Стероидный гормон – альдостерон — важный минералкортикоид, синтезирующийся в клубочковой зоне коры надпочечников. Его синтез и выделение контролируются ренин-ангиотензин-альдостероновой системой, а также концентрацией калия в плазме, пептидом АКТГ и давлением посредством давления чувствительных барорецепторов в стенках почти всех крупных артерий тела человека. Альдостерон связывается с рецепторами минералкортикоидов и запускает транскрипцию гормон — ответственных генов. В результате альдостерон повышает давление крови за счет реабсорбции натрия и воды из дистальных канальцев почек в кровь, секреции калия в мочу и повышения объема циркулирующей крови. Хроническое гиперпродуцирование и секреция альдостерона ведет к гипертензии. Активность альдостерона уменьшается при болезни Адиссона и возрастает при синдроме Конна.
Измерение уровня альдостерона в сыворотке в сочетании с уровнем ренина в плазме используется для дифференциации первичного и вторичного альдотеронизма.
1. Brown RD, Strott CA, and Liddle GW. Site of stimulation of Aldosterone biosynthesis by angiotensin and potassium. J Clin Invest. (1972), 51 (6), 1413–8.
2. Bauer JH, Gauntner WC. Effect of potassium chloride on plasma renin activity and plasma aldosterone during sodium restriction in normal man. Kidney Int. (1979), 15 (3): 286–93.
3. Williams GH, Dluhy RG. Aldosterone biosynthesis. Interrelationship of regulatory factors. Am J Med. (1972), 53 (5), 595–605.
4. Tiu SC et al. The use of aldosterone-renin ratio as a diagnostic test for primary hyperaldosteronism and its test characteristics under different conditions of blood sampling. J Clin Endocrinol Metab. (2005), 90 (1), 72-8.
5. Mulatero P et al. Confirmatory tests in the diagnosis of primary aldosteronism. Horm Metab Res. (2010), 42 (6), 406-10.
6. Quillo AR. Primary aldosteronism: results of adrenalectomy for nonsingle adenoma. J Am Coll Surg. (2011), 213 (1), 106-12.
7. Grossmann C and Gekle M. New aspects of rapid aldosterone signaling. Mol Cell Endocrinology (2009), 308 (1-2), 53-62.
8. Thomas L (editor). Renin-Angiotensin-Aldosteron-System (RAAS). Labor und Diagnose (2005); 1406-24.
9. Perschel FH et al. Rapid Screening test for primary hyperaldosteronism: ratio of plasma aldosterone to renin concentration determined by fully automated chemiluminescence immunoassays. Clin. Chemistry (2004); 50 (9), 1650-55.
[quickshop product="Альдостерон, EIA5298"]
Ренин, EIA5125
Ренин – это фермент (м.в. 37 кДа), который принадлежит семейству протеаз аспарагиновой кислоты. Ренин — участник Ренин-Ангиотензин-Альдостероновой Системы (РААС (RAAS)), которая управляет кровяным давлением, почечным кровотоком, клубочковой фильтрацией, и калиево-натриевым гомеостазом.
Ренин постоянно производится как проренин, неактивный предшественник с 386 аминокислотами, в юкстагломерулярных клетках почки (1). В ответ на низкое внутрипочечное кровяное давление, уменьшенную реабсорбцию натрия, гипогалиемию или активность симпатической нервной системы, активный ренин может быть высвобожден или из депо в почке или произведен от проренина отщеплением 46 аминокислот на N-конце проренина (2,3). Секреция проренина в кровь непрерывна, в отличие от жестко управляемого высвобождения ренина. Концентрация в крови проренина является приблизительно 100 крат выше, чем активный ренин (4,5). После высвобождения и активации, растворенный ренин способствует расщеплению α2-глобулина ангитензиногена в пептид-предшественник ангиотензин I, который полностью перерабатывается ангиотензин-превращающим ферментом (АПФ, (АСЕ)) в октапептид ангиотензин II. Все действия ангиотензина II опосредованы рецепторами G-белок-ангиотензин 1 типа (AT1) и ангиотензин 2 типа (AT2) (6). Прямые физиологические эффекты Ангиотензина II включают сужение сосудов, увеличение канальцевой реабсорбции натрия и хлоридов, удержания воды и высвобождение гормонов: альдостерона из коры надпочечников, антидиуретического гормона (АДГ (ADH), Вазопрессин) из задней доли гипофиза и адренокортикотропного гормона (АКТГ (ACTH), Кортикотропин) из передней доли гипофиза. Выпуск этих гормонов способствует удержанию натрия и секреции калия/H+ в почке, усиливая таким образом чувство жажды и желание употребить соль через субфорникальный орган мозга (7,8). В отрицательной петле обратной связи секреция ренина уменьшается высокой концентрацией ангиотензина II (9), а выпуск альдостерона снижается уменьшением калия (10). Несмотря на действия растворенного ренина, закрепление ренина и проренина на мембранный рецептор ренина ATP6AP2 в мозге, сердце, плаценте, печени, почках и поджелудочной железе увеличивает эффективность расщепления ангиотензина и вызывает независимые от ангиотензина внутриклеточные эффекты, мобилизируя киназы, активизированные митогеном, ERK1 и ERK2 (11).
Плазменный ренин — хороший показатель деятельности РААС. В случае дисфункции РААС анализ Ренина дает клинические значения для диагноза, обработки и последующих действий. Активный ренин должен быть измерен при:
o Диагностике гипертонии (высокое кровяное давление: если диастолическое кровяное давление > 90 мм Hg и систолическое кровяное давление > 140 мм Hg; директива европейского Общества Кардиологии и европейского Общества Гипертонии)
o Дифференциальной диагностике гиперальдостеронизм (первичный гиперальдостеронизм, вторичный гиперальдостеронизм с или без гипертонии, псевдогиперальдостеронизм)
o Диагностике изолированного дефицита минерал-кортикоидов
o Дифференциальной диагностике (вторичный гиперальдостеронизм или первичный гиперминералкортицизм)
o Обнаружение Ренин-продуцирующих опухолей в почке
o Контроле глюкокортикоидной терапии
o Диагнозе недостаточного ответа на противогипертоническое лечение.
1. Imai T, Miyazaki H, Hirose S, et al. Cloning and sequence analysis of cDNA for human renin precursor. Proc. Natl. Acad. Sci. (1983) 80, 7405–7409.
2. Reudelhuber TL, Ramla D, Chiu L, et al. Proteolytic processing of human prorenin in renal and non-renal tissues. Kidney Int. (1994) 46, 1522–1524.
3. Neves FA, Duncan KG, Baxter JD. Cathepsin B is a prorenin processingenzyme. Hypertension (1996) 27, 514 –517.
4. Müller DN, Luft FC. Direct renin inhibition with aliskiren in hypertension and target organ damage. Clin J Am Soc Nephrol. (2006) 1, 221-8.
5. Toffelmire EB, Slater K, Corvol P, et al. Response of plasma prorenin and active renin to chronic and acute alterations of renin secretion in normal humans. Studies using a direct immunoradiometric assay. J Clin Invest. (1989) 83, 679–687.
6. Carey RM, Padia SH. Angiotensin AT2 receptors: control of renal sodium excretion and blood pressure. Trends Endocrinol Metab. (2008) 19, 84-7.
7. Koeppen BM, Stanton BA. Renal Physiology (4th ed.). Philadelphia, PA. Mosby Physiology Monograph Series, 2007.
8. Navar LG, Inscho EW, Majid DSA, et al. Paracrine regulation of the renal microcirculation. Physiol. Rev. (1996) 76, 425–536.
9. Müller MW, Todorov V, Krämer BK, Kurtz A. Angiotensin II inhibits renin gene transcription via the protein kinase C pathway. Pflugers Arch. (2002) 444, 499-505.
10. Spät A, Hunyady L. Control of aldosterone secretion: a model for convergence in cellular signaling pathways. Physiol Rev. (2004) 84, 489-539.
11. Nguyen G., Delarue F., Burcklé C., et al. Pivotal role of the renin/prorenin receptor in angiotensin II production and cellular responses to renin. J Clin Invest. (2002) 109, 1417–1427.
12. Pitarresi TM., Rubattu S, Heinrikson R, Sealey JE. Reversible cryoactivation of recombinant human prorenin. J.Biol.Chem. (1992) 267, 11753-9.
13. Nicar MJ. Specimen processing and renin activity in plasma. Clin. Chem. (1992) 38, 598.
[quickshop product="Ренин, EIA5125"]